Un mondo uno combattimento
─ Cooperazione internazionale per costruire una comunità globale di destino comune che risponde alla sfida pandemica di Covid-19
Il romanzo coronavirus che spazzava in tutto il mondo ha portato a una crisi pandemica globale in corso Covid-19. Il romanzo Coronavirus non ha confini, nessun paese sarà risparmiato da questa battaglia contro Covid-19. In risposta a questa pandemia di Covid-19 in tutto il mondo, Bio-Products Corp sta dando contributi per sostenere il benessere delle nostre comunità globali.
Il nostro mondo è attualmente affrontato dall'impatto senza precedenti della nuova pandemia di Malattia Coronavirus 2019 (Covid-19). Ad oggi, non esiste un farmaco efficiente disponibile per il trattamento di questa malattia. Tuttavia, sono stati sviluppati molti test diagnostici per il rilevamento di Covid-19. Questi test si basano su metodi molecolari o sierologici per rilevare i nuovi biomarcatori nucleici o anticorpi specifici del coronavirus. Poiché Covid-19 ha raggiunto uno stato pandemico, la diagnosi precoce della nuova infezione da coronavirus è fondamentale per valutare la diffusione del virus e contenentelo, ma non esiste ancora un test perfetto per l'uso universale. Dobbiamo sapere quali test potrebbero essere potenzialmente utilizzati per lo screening, la diagnosi e il monitoraggio dell'infezione Covid-19 e quali sono i loro limiti. È molto importante come sfruttare meglio questi strumenti scientifici e aiutare a identificare e controllare l'emergere di questa malattia in rapida diffusione e grave.
Lo scopo del rilevamento del nuovo coronavirus è determinare se un individuo che ha un'infezione covid-19 o un vettore asintotico che può diffondere il virus silenziosamente, per fornire informazioni essenziali per guidare il processo decisionale per il trattamento clinico. Precedenti studi hanno dimostrato che il 70% delle decisioni cliniche dipende dai risultati dei test. Quando vengono utilizzati diversi metodi di rilevamento, anche i requisiti dei kit di reagenti di rilevamento sono diversi.
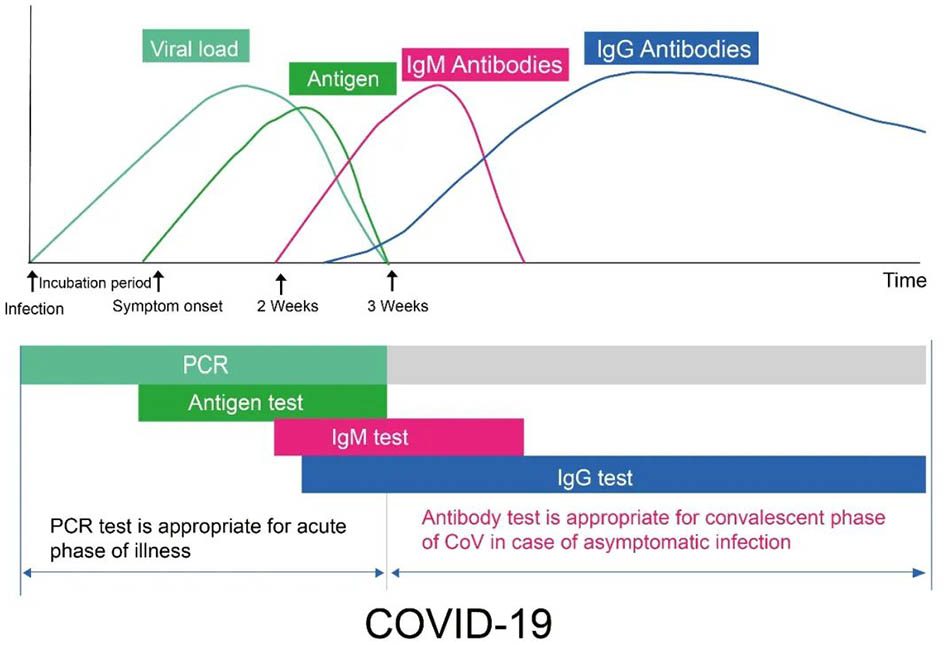
Figura 1
Figura1:Diagramma che mostra le fasi chiave dei livelli generali di biomarcatori durante il tipico decorso temporale dell'infezione da Covid-19. L'asse X indica il numero di giorni di infezione e l'asse Y indica la carica virale, la concentrazione di antigeni e la concentrazione di anticorpi in diversi periodi. L'anticorpo si riferisce agli anticorpi IgM e IgG. Sia RT-PCR che il rilevamento dell'antigene sono usati per rilevare la presenza o l'assenza di nuovo coronavirus, che è una prova diretta per il rilevamento precoce dei pazienti. Entro una settimana da infezione virale, il rilevamento della PCR o il rilevamento dell'antigene sono preferiti. Dopo la nuova infezione da coronavirus per circa 7 giorni, l'anticorpo IgM contro il nuovo coronavirus è gradualmente aumentato nel sangue del paziente, ma la durata dell'esistenza è breve e la sua concentrazione diminuisce rapidamente. Al contrario, l'anticorpo IgG contro il virus appare più tardi, di solito circa 14 giorni dopo l'infezione da virus. La concentrazione di IgG aumenta gradualmente e persiste un lungo periodo nel sangue. Pertanto, se l'IGM viene rilevata nel sangue del paziente, significa che il virus ha recentemente infettato, che è un marcatore di infezione precoce. Quando l'anticorpo IgG viene rilevato nel sangue del paziente, significa che l'infezione virale è stata per qualche tempo. È anche chiamato infezione tardiva o infezione precedente. È spesso visto nei pazienti che sono in fase di recupero.
I biomarcatori del nuovo coronavirus
Il nuovo coronavirus è un virus dell'RNA, composto da proteine e acidi nucleici. Il virus invade il corpo dell'ospite (umano), entra nelle cellule attraverso il corrispondente recettore Ace2 del sito di legame e si replica nelle cellule ospiti, causando la risposta al sistema immunitario umano agli invasori stranieri e producono anticorpi specifici. Pertanto, gli acidi nucleici della fiala e gli antigeni e anticorpi specifici contro il nuovo coronavirus possono teoricamente essere usati come biomarcatori specifici per il rilevamento del nuovo coronavirus. Per il rilevamento dell'acido nucleico, la tecnologia RT-PCR è la più comunemente utilizzata, mentre i metodi sierologici sono comunemente usati per il rilevamento dei nuovi anticorpi specifici del coronavirus. Attualmente, sono disponibili una varietà di metodi di prova che possiamo scegliere per il test dell'infezione da Covid-19 [1].
Principi di base dei principali metodi di test per nuovo coronavirus
Molti test diagnostici per Covid_19 sono disponibili finora, con più kit di test che ricevono l'approvazione in base all'autorizzazione dell'uso di emergenza ogni giorno. Sebbene i nuovi sviluppi dei test che escono con così tanti nomi e formati diversi, tutti gli attuali test Covid_19 si basano sostanzialmente su due principali tecnologie: il rilevamento di acidi nucleici per l'RNA virale e i test immuno-sierologici che rilevano anticorpi virali (IgM e IGM).
01. Rilevazione dell'acido nucleico
Reazione a catena della trascrizione inversa-polimerasi (RT-PCR), amplificazione isotermica mediata da loop (lampada) e sequenziamento di prossima generazione (NGS) sono i metodi comuni di acido nucleico per il rilevamento di nuovi RNA di coronavirus. RT-PCR è il primo tipo di test per Covid-19, raccomandato sia dall'Organizzazione mondiale della sanità (OMS) sia dal Centro degli Stati Uniti per il controllo e la prevenzione delle malattie (CDC).
02. Rilevamento di anticorpi serologici
L'anticorpo è una proteina protettiva prodotta nel corpo umano in risposta all'infezione da virus. L'IGM è un primo tipo di anticorpo mentre IgG è un anticorpo di tipo successivo. Il campione sierico o plasmatico viene generalmente esaminato per la presenza di specifici tipi di anticorpi IgM e IgG dell'anticorpo per la valutazione delle fasi acute e convalescenti dell'infezione da Covid-19. Questi metodi di rilevamento basati su anticorpi includono il test immunocromatografico dell'oro colloidale, l'immunocromatografia di microsfera fluorescente, il test immunosorbente legato agli enzimi (ELISA) e il test chemiluminescenza.
03. Rilevamento dell'antigene virale
L'antigene è una struttura sul virus riconosciuto dal corpo umano che innesca il sistema di difesa immunitaria per produrre anticorpi per liberare il virus dal sangue e dai tessuti. Un antigene virale presente sul virus può essere preso di mira e rilevato usando il test immunologico. Come l'RNA virale, anche gli antigeni virali sono presenti nel tratto respiratorio di individui infetti e possono essere utilizzati per diagnosticare la fase acuta dell'infezione da Covid-19. Pertanto, si raccomanda spesso di raccogliere esemplari respiratori superiori come saliva, tamponi rinofaringei e orofaringei, espettorato di tosse profonda, liquido di lavaggio broncoalveolare (BALF) per test antigene iniziali.
Selezione dei metodi di test per nuovo coronavirus
La selezione di un metodo di test prevede molti fattori, tra cui l'impostazione clinica, il controllo di qualità del test, il tempo di consegna, i costi di test, i metodi di raccolta del campionamento, i requisiti tecnici del personale di laboratorio, le strutture e le attrezzature. Il rilevamento di acidi nucleici o antigeni virali è quello di fornire prove dirette della presenza dei virus e confermare la diagnosi di nuova infezione da coronavirus. Sebbene ci siano molti metodi per il rilevamento dell'antigene, la loro sensibilità di rilevamento del nuovo coronavirus è teoricamente inferiore a quella dell'amplificazione RT-PCR. Il test degli anticorpi è il rilevamento di anticorpi anti-virus prodotti nel corpo umano, che è in ritardo nel tempo e spesso non può essere usato per il rilevamento precoce durante la fase acuta dell'infezione da virus. L'impostazione clinica per le applicazioni di rilevamento può variare e anche i siti di raccolta del campione possono essere diversi. Per la rilevazione di acidi nucleici virali e antigeni, il campione deve essere raccolto nel tratto respiratorio in cui è presente il virus, come tamponi rinofaringei, tamponi orofaringei, espettorato o fluido di lavaggio broncoalveolare (BALF). Per il rilevamento a base di anticorpi, il campione di sangue deve essere raccolto ed esaminato per la presenza di specifico anticorpo antivirus (IgM/IgG). Tuttavia, i risultati dei test di anticorpi e acido nucleico possono completarsi a vicenda. Ad esempio, quando il risultato del test è l'acido nucleico negativo, negativo dalle IgM ma positivo alle IgG, questi risultati indicano che il paziente non porta attualmente il virus, ma è stato recuperato dalla nuova infezione da coronavirus. [2]
Vantaggi e svantaggi dei nuovi test del coronavirus
Nel protocollo di diagnosi e trattamento per la nuova polmonite da coronavirus (prove versione7) (rilasciata dalla National Health Commission & State Administration della medicina tradizionale cinese il 3 marzo 2020), il test dell'acido nucleico è usato come metodo di gold standard L'infezione da coronavirus, mentre i test anticorpi sono anche considerati uno dei metodi di conferma per la diagnosi.

Risultati patogeni e sierologici
(1) Risultati patogeni: il nuovo acido nucleico del coronavirus può essere rilevato in tamponi rinofaringei, espettorato, secrezioni del tratto respiratorio inferiore, sangue, feci e altri campioni usando metodi RT-PCRAND/o NGS. È più accurato se i campioni sono ottenuti da un tratto respiratorio inferiore (espettorato o estrazione del tratto d'aria). I campioni devono essere presentati per i test il prima possibile dopo la raccolta.
(2) Risultati sierologici: le IgM specifiche del virus NCP diventano rilevabili intorno a 3-5 giorni dopo l'insorgenza; L'IGG raggiunge una titolazione di almeno 4 volte aumento durante la convalescenza rispetto alla fase acuta.
Tuttavia, la selezione dei metodi di test dipende da posizioni geografiche, regolamenti medici e impostazioni cliniche. Negli Stati Uniti, il NIH ha emesso le linee guida per il trattamento della malattia del coronavirus 2019 (Covid-19) (sito aggiornato: 21 aprile2020) e la FDA ha emesso una politica per i test diagnostici per la malattia del coronavirus-2019 durante l'emergenza di salute pubblica (emessa il 16 marzo 162020 ), in cui i test sierologici degli anticorpi IgM/IgG selezionati solo come test di screening.
Metodo di rilevamento dell'acido nucleico
RT_PCR è un test di acido nucleico altamente sensibile progettato per rilevare se il nuovo RNA di coronavirus è presente o meno nel campione respiratorio o altro. Un risultato positivo del test di PCR indica la presenza di un nuovo RNA di coronavirus nel campione per confermare l'infezione da Covid-19. Un risultato negativo del test di PCR non significa l'assenza dell'infezione da virus perché potrebbe essere influenzato da una scarsa qualità del campione o dal punto temporale della malattia nella fase recuperata, ecc. Sebbene RT-PCR sia un test altamente sensibile, ha diversi inconvenienti. I test RT-PCR possono essere ad alta intensità di manodopera e dispendiosi in termini di tempo, fondamentalmente dipendenti dall'alta qualità del campione. Questa può essere una sfida perché la quantità di RNA virale non solo varia enormemente tra i pazienti diversi, ma può anche variare all'interno dello stesso paziente a seconda dei punti temporali in cui viene raccolto il campione e delle fasi di infezione o dell'insorgenza dei sintomi clinici. Il rilevamento del nuovo coronavirus richiede campioni di alta qualità che contengono una quantità sufficiente di RNA virale intatto.
Il test RT-PCR può fornire un risultato negativo errato (falso negativo) per alcuni pazienti che hanno un'infezione da Covid-19. Come sappiamo, i principali siti di infezione del nuovo coronavirus si trovano nel polmone e nel tratto respiratorio inferiore, come Alveoli e Bronchi. Pertanto, il campione espettorato da una tosse profonda o il fluido di lavaggio broncoalveolare (BALF) ha ritenuto di avere la massima sensibilità per il rilevamento virale. Tuttavia, nella pratica clinica, i campioni vengono spesso raccolti dal tratto respiratorio superiore usando tamponi rinofaringei o orofaringei. La raccolta di questi campioni non è solo scomodo per i pazienti, ma richiede anche personale appositamente addestrato. Per rendere il campionamento meno invasivo o più facile, in alcuni casi i pazienti possono essere somministrati un tampone orale e consentire loro di prelevare un campione dalla mucosa buccale o dalla lingua che si stacca. Senza RNA virale sufficiente, RT-QPCR può restituire un risultato del test falso negativo. Nella provincia di Hubei, in Cina, sensibilità RT-PCR nella rilevazione iniziale è stata riportata solo circa il 30%-50%, con una media del 40%. L'alto tasso di falso negativo è stato probabilmente causato da un campionamento insufficiente.
Inoltre, il test RT-PCR richiede al personale altamente qualificato per eseguire fasi di estrazione di RNA complesse e procedura di amplificazione della PCR. Richiede inoltre un livello più elevato di protezione della biosicurezza, struttura di laboratorio speciale e strumento PCR in tempo reale. In Cina, il test RT-PCR per il rilevamento di Covid-1 deve essere eseguito nei laboratori di livello 2 di biosicurezza (BSL-2), con protezione del personale che utilizza la pratica di livello 3 (BSL-3) di biosicurezza. In base a questi requisiti, dall'inizio di gennaio all'inizio di febbraio 2020, la capacità del laboratorio CDC di Cina Wuhan era in grado di rilevare solo alcune centinaia di casi al giorno. Normalmente, questo non sarebbe un problema quando si testano altre malattie infettive. Tuttavia, quando si tratta di una pandemia globale come Covid-19 con potenzialmente milioni di persone da testare, RT-PCR diventa un problema critico a causa dei suoi requisiti per speciali strutture di laboratorio o attrezzature tecniche. Questi svantaggi possono limitare la RT-PCR da utilizzare come strumento efficiente per lo screening e possono anche portare a ritardi nei report dei risultati dei test.
Metodo di rilevamento degli anticorpi sierologici
Con il progresso del corso della malattia, specialmente nelle fasi centrali e tardive, il tasso di rilevamento degli anticorpi è molto elevato. Uno studio nel Wuhan Central South Hospital ha dimostrato che il tasso di rilevamento degli anticorpi potrebbe raggiungere oltre il 90% nella terza settimana di infezione da Covid-19. Inoltre, l'anticorpo è il prodotto della risposta immunitaria umana contro il nuovo coronavirus. Il test degli anticorpi offre diversi vantaggi rispetto a RT-PCR. In primo luogo, l'anticorpo sierologico verifica semplice e rapido. I test di flusso laterale dell'anticorpo possono essere utilizzati per il punto di cura per fornire un risultato in 15 minuti. In secondo luogo, il bersaglio rilevato dal test sierologico è l'anticorpo, che è noto per essere molto più stabile dell'RNA virale. Durante la raccolta, il trasporto, lo stoccaggio e i test, i campioni per i test di anticorpi sono generalmente più stabili rispetto ai campioni per RT-PCR. In terzo luogo, poiché l'anticorpo è distribuito uniformemente nella circolazione sanguigna, vi è una minore variazione di campionamento rispetto al test di acido nucleico. Il volume del campione richiesto per il test degli anticorpi è relativamente piccolo. Ad esempio, 10 microlitri di sangue di prick di dita sono sufficienti per l'uso nel test di flusso laterale anticorpo.
In generale, il test degli anticorpi è scelto come strumento di supplemento per il rilevamento dell'acido nucleico per migliorare il tasso di rilevamento del nuovo coronavirus durante i corsi di malattia. Quando il test degli anticorpi viene utilizzato insieme a un test di acido nucleico, può aumentare l'accuratezza del test per la diagnosi di Covid19 riducendo potenziali risultati falsi positivi e falsi negativi. L'attuale guida operativa non consiglia di utilizzare due tipi di test separatamente come formato di rilevamento indipendente ma dovrebbe essere utilizzata come formato combinato. [2]
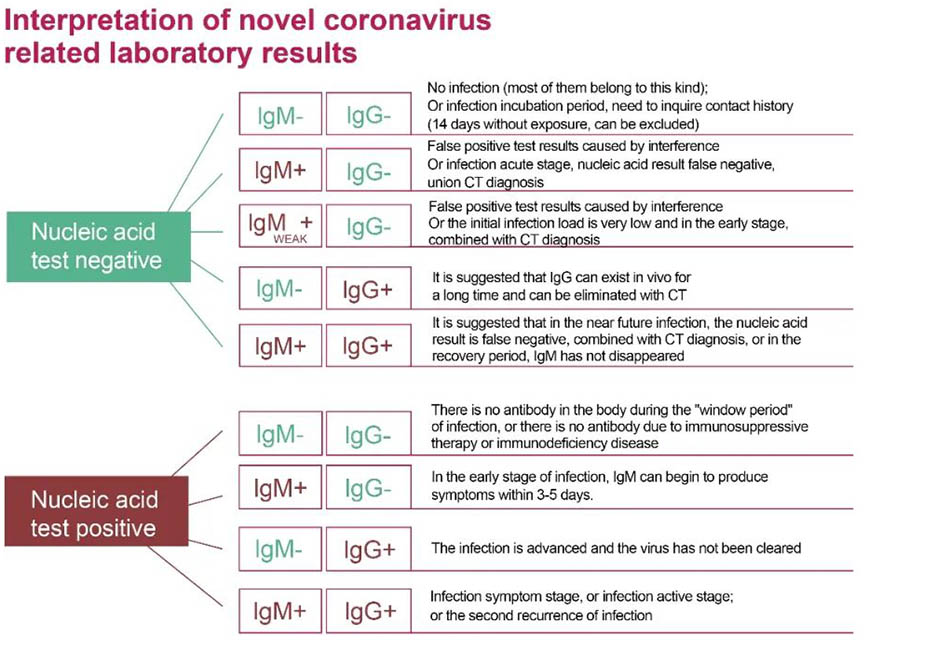
Figura2:La corretta interpretazione dell'acido nucleico e dei test di test anticorpi per il rilevamento di nuove infezioni da coronavirus

Figura 3:Liming Bio-Products Co., Ltd.-Nuovo Kit di test rapido con anticorpo IgM/IgG (Strongstep (Strongstep®Test rapido dell'anticorpo IgM/IgG SARS-2/IgG, immunocromatografia in lattice)

Figura 4:Liming Bio-Products Co., Ltd.-Strongstep®Nuovo kit PCR multiplex in tempo reale di coronavirus (SARS-CoV-2) (rilevamento per tre geni, metodo della sonda fluorescente).
Nota:Questo kit PCR altamente sensibile e pronto all'uso è disponibile in formato liofilizzato (processo di liofilizzazione) per la conservazione a lungo termine. Il kit può essere trasportato e conservato a temperatura ambiente ed è stabile per un anno. Ogni tubo di Premix contiene tutti i reagenti necessari per l'amplificazione della PCR, tra cui la transscripse inversa, la taq polimerasi, i primer, le sonde e i substrati DNTP. su uno strumento PCR per eseguire l'amplificazione.
In risposta al nuovo focolaio di Coronavirus, Liming Bio-Products Co., Ltd. ha lavorato rapidamente per sviluppare due kit diagnostici per consentire ai laboratori clinici e di salute pubblica di diagnosticare rapidamente l'infezione da Covid-1. Questi kit sono molto adatti per l'uso per lo screening su larga scala in paesi e regioni in cui il nuovo focolaio di coronavirus si sta rapidamente diffondendo e per fornire diagnosi e conferma per l'infezione da Covid-19. Questi kit sono per l'uso solo sotto l'autorizzazione di uso di emergenza pre-notificato (PEUA). I test sono limitati ai laboratori certificati ai sensi delle normative delle autorità nazionali o locali.
Metodo di rilevamento dell'antigene
1. Il rilevamento dell'antigene virale è classificato nella stessa categoria di rilevamento diretto della rilevazione dell'acido nucleico. Questi metodi di rilevamento diretto cercano prove di agenti patogeni virali nel campione e possono essere utilizzati per la diagnosi di conferma. Tuttavia, lo sviluppo di kit di rilevamento dell'antigene richiede un'alta qualità di anticorpi monoclonali con forte affinità e alta sensibilità in grado di riconoscere e catturare virus patogeni. Di solito ci vogliono più di sei mesi per selezionare e ottimizzare un anticorpo monoclonale adatto per l'uso nella preparazione del kit di rilevamento dell'antigene.
2. Attualmente, i reagenti per il rilevamento diretto del nuovo coronavirus sono ancora in fase di ricerca e sviluppo. Pertanto, nessun kit di rilevamento dell'antigene è stato clinicamente validato e disponibile in commercio. Sebbene in precedenza è stato riferito che un'impresa diagnostica a Shenzhen ha sviluppato un kit di rilevamento di antigene e testata clinicamente in Spagna, l'affidabilità e l'accuratezza del dosaggio non potevano essere validate a causa della presenza di problemi di qualità del reagente. Ad oggi, NMPA (ex FDA cinese) non ha ancora approvato alcun kit di rilevamento di antigene per uso clinico. In conclusione, sono stati sviluppati una varietà di metodi di rilevamento. Ogni metodo ha i suoi vantaggi e limitazioni. I risultati di diversi metodi possono essere utilizzati per la verifica e il complemento.
3. La produzione di un kit di test Covid-19 di qualità dipende fortemente dall'ottimizzazione durante la ricerca e lo sviluppo. Liming Bio-Product Co., Ltd. I kit di test sono tenuti a soddisfare rigorosi standard di produzione e di controllo della qualità per garantire che forniscano i più alti livelli di prestazioni e coerenza. Gli scienziati di Liming Bio-Product Co., Ltd. hanno un'esperienza di oltre vent'anni nella progettazione, test e ottimizzazione dei kit diagnostici in vitro per garantire il massimo livello di prestazioni nella quantificazione analitica.
Durante la pandemia di Covid-19, il governo cinese ha affrontato l'enorme domanda di materiali di prevenzione epidemica negli hotspot internazionali. Il 5 aprile, alla conferenza stampa del meccanismo di prevenzione e controllo congiunta del Consiglio di Stato "rafforzando la gestione della qualità dei materiali medici e regolando l'ordine del mercato", Jiang Fan, ispettore di primo livello del dipartimento del commercio estero del Ministero del commercio, ha dichiarato: "Successivamente, concentreremo i nostri sforzi su due aspetti, in primo luogo, per accelerare il supporto di più forniture mediche necessarie per la comunità internazionale e anche per migliorare il controllo, la regolamentazione e la gestione della qualità dei prodotti. Daremo il contributo della Cina alla risposta congiuntamente all'epidemia globale e alla costruzione di una comunità con un futuro condiviso per l'umanità.



Figura 5:Liming Bio-Products Co., il nuovo reagente Coronavirus di Ltd. ha ottenuto il certificato di registrazione UE
Il certificato onorario


Houshenshan
Figura 6. Liming Bio-Products Co., Ltd. Supportato l'ospedale montuoso di Wuhan Vulcan (Houshenshan) per combattere contro l'epidemia di Covid-19 e gli è stato assegnato il certificato onorario della Croce Rossa di Wuhan. Wuhan Vulcan Mountain Hospital è l'ospedale più famoso in Cina specializzato nel trattamento di covidi gravi - 19 pazienti.
Mentre il nuovo focolaio di Coronavirus continua a diffondersi in tutto il mondo, Nanjing Liming Bio-Products Co., Ltd. si sta intensificando per sostenere e aiutare le comunità in tutto il mondo con le nostre tecnologie innovative per combattere questa minaccia globale senza precedenti. I test rapidi dell'infezione da Covid-19 sono una parte fondamentale per affrontare questa minaccia. Continuiamo a contribuire in modo significativo fornendo piattaforme diagnostiche di alta qualità nelle mani degli operatori sanitari in prima linea in modo che le persone possano ricevere i risultati dei test critici di cui hanno bisogno. Liming Bio-Products Co., Ltd. Gli sforzi della battaglia contro la pandemia di Covid-19 stanno per contribuire con le nostre tecnologie, esperienze e competenze alle comunità internazionali per la costruzione di una comunità globale di destino.
Premere a lungo ~ scansionci e seguici
E-mail: sales@limingbio.com
Sito web: https://limingbio.com
Tempo post: maggio-01-2020







